
En 2016, le Chapitre[1] “<1207> Package integrity evaluation – sterile products” de l’USP[2] a été mis à jour, remettant sérieusement en cause l’unique utilisation des méthodes historiques telles que les tests au bleu ou les tests microbiologiques. Dans ce Chapitre, la méthode microbiologique est nommée “Microbial Challenge, Immersion Exposure” et la méthode au bleu est comprise dans les méthodes dites “Tracer Liquid”. Ces deux méthodes sont catégorisées comme des “probabilistic methods”. Les méthodes probabilistes se caractérisent par la nature aléatoire des phénomènes permettant le passage du liquide dans les échantillons. A l’opposé l’USP définit les “deterministic methods” comme des techniques physico-chimiques permettant l’obtention de résultats quantifiables, reproductibles avec des limites de détection clairement définies et prévisibles.
Pour les deux cas, la méthode microbiologique ou au bleu, le principe de base est similaire. Il s’agit de détecter le passage d’un liquide à l’intérieur d’un contenant. Le passage du liquide est relevé par une coloration ou un développement microbien.
Nous étudierons içi la méthode au bleu de méthylène.
Méthode de test au bleu de méthylène ou Dye Ingress
Les échantillons sont d’abord remplis de produit. Un échantillon vide peut également être testé mais généralement le passage est favorisé entre deux liquides. Les échantillons sont ensuite immergés dans une solution de colorant.
Afin d’améliorer la pénétration du colorant, les échantillons sont soumis à une dépression pendant un temps déterminé, on laisse ensuite le produit revenir à la pression atmosphérique et il faut ensuite patienter pendant le temps de pénétration. C’est l’étape la plus importante du test.
Différents colorants peuvent être utilisés, historiquement il s’agit de solution de bleu de méthylène (la plupart du temps des solutions dosées à 1g/L). A la fin du cycle complet de test, les échantillons sont nettoyés puis lus. La lecture des échantillons peut se faire visuellement ou à l’aide de spectrophotomètre. Si l’un des échantillons présente une coloration interne, l’échantillon est déclaré fuyard.
Les témoins positifs et les limites de détection
En parallèle des tests, des témoins positifs doivent être effectués en utilisant des échantillons dans lesquels des “trous” sont réalisés.
L’utilisation des échantillons plutôt que de témoins standards permet de simuler réellement le test. Par rapport à certaines méthodes déterministes, l’utilisation de témoin positif permet de revérifier à chaque session de test, la limite de détection sur l’échantillon réel.
A noter que les limites de détection varient en fonction du type de contenant. Plus le contenant est grand (plusieurs litres, par exemple), plus la limite de détection sera importante. La limite de détection est corrélée à la capacité du liquide à pénétrer le contenant.
Par exemple, pour une poche souple de liquide de 20 Litres, la limite de détection sera généralement supérieure à 100μm alors que pour une seringue ou un acon de quelques millilitres, la limite de détection pourra être abaissée à 30μm avec des variations de pression suffisamment fortes.
Afin de générer les témoins positifs, des microtubes ou microcapillaires peuvent être utilisés pour simuler les micro-trous dans les échantillons.
La réalisation des témoins positifs est une tâche délicate. Durant la préparation puis durant l’insertion des capillaires dans les échantillons, il est important de ne pas boucher les capillaires ni de les casser.
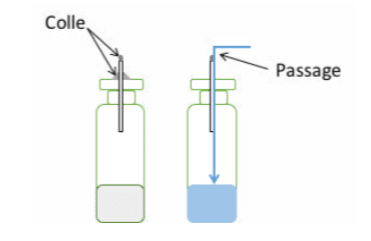
Un autre point essentiel réside dans la fixation des capillaires. Si un capillaire n’est pas scellé ou pas correctement scellé à l’échantillon, le liquide passera à côté de celui-ci plutôt qu’à l’intérieur (voir Figure 1), ceci même si le capillaire est introduit dans un bouchon caoutchouc.
Celui-ci ne se rétracte pas parfaitement autour du capillaire et laisse un passage pour le liquide. A noter qu’il existe également une corrélation entre la longueur des capillaires et la probabilité de passage à travers celui-ci, d’où la nécessité de réaliser une validation avant d’entreprendre des tests de routine.
Avantages et inconvénients de cette méthode
Cette méthode présente un certain nombre d’inconvénients connus :
- C’est une méthode “destructive”, les échantillons ne doivent pas être réutilisés,
- Directement lié au point précédent, il faut gérer les déchets générés, attention aux produits souillés par du bleu de méthylène.
- Les limites de détection sont relativement hautes, néanmoins elles peuvent être améliorées en appliquant de fortes variations de pression,
- Le temps d’analyse est long, la plupart du temps, il faut laisser au moins 30 minutes au bleu pour pénétrer.
Malgré ces inconvénients, cette méthode reste avantageuse dans bon nombre de cas :
- Elle fonctionne aussi bien sur les petits ou les grands volumes et également sur des emballages de différentes formes et fermés avec des méthodes différentes.
- Elle est assez simple à mettre en place et ne demande pas de matériel hors de prix.
[1] PDA, Development of a Dye Ingress Method to Assess Container-Closure Integrity: Correlation to Microbial Ingress
[2] USP: The U.S. Pharmacopeial Convention






