
Im Jahr 2016 wurde das USP[2] Kapitel[1] „<1207> Bewertung der Unversehrtheit von Verpackungen – sterile Produkte“ aktualisiert, wobei die alleinige Anwendung historischer Methoden wie Blautests oder mikrobiologischer Tests ernsthaft in Frage gestellt wurde. In diesem Kapitel wird die mikrobiologische Methode als „Microbial Challenge, Immersion Exposure“ bezeichnet und die blaue Methode ist in den sogenannten „Tracer Liquid“-Methoden enthalten. Diese beiden Methoden werden als „probabilistische Methoden“ kategorisiert. Probabilistische Methoden zeichnen sich durch den Zufallscharakter der Phänomene aus, die den Durchgang der Flüssigkeit durch die Proben ermöglichen. Im Gegensatz dazu definiert die USP „deterministische Methoden“ als physikalisch-chemische Techniken, die quantifizierbare, reproduzierbare Ergebnisse mit klar definierten und vorhersehbaren Nachweisgrenzen ermöglichen.
In beiden Fällen, der mikrobiologischen oder der blauen Methode, ist das Grundprinzip ähnlich. Ziel ist es, den Durchfluss einer Flüssigkeit in einem Behälter festzustellen. Der Durchfluss der Flüssigkeit wird durch Färbung oder mikrobielles Wachstum nachgewiesen.
Im Folgenden werden wir die Methylenblau-Methode betrachten.
Methylenblau-Testverfahren oder Dye Ingress
Die Proben werden zunächst mit Produkt gefüllt. Es kann auch eine leere Probe getestet werden, aber im Allgemeinen wird der Durchgang zwischen zwei Flüssigkeiten bevorzugt. Die Proben werden dann in eine Farbstofflösung getaucht.
Um das Eindringen des Farbstoffs zu verbessern, werden die Proben für eine bestimmte Zeit einem Vakuum ausgesetzt, dann wird das Produkt wieder auf Atmosphärendruck gebracht und die Durchdringungszeit abgewartet. Dies ist die wichtigste Phase des Tests.
Es können verschiedene Farbstoffe verwendet werden, in der Regel Methylenblaulösung (meist in einer Dosierung von 1 g/l). Am Ende des gesamten Prüfzyklus werden die Proben gereinigt und anschließend abgelesen. Die Proben können visuell oder mit einem Spektralphotometer abgelesen werden. Wenn eine der Proben eine Innenfärbung aufweist, wird die Probe als undicht eingestuft.
Positivkontrollen und Nachweisgrenzen
Parallel zu den Tests müssen Positivkontrollen mit Proben durchgeführt werden, in die „Löcher“ gebohrt werden.
Die Verwendung von Proben anstelle von Standardkontrollen ermöglicht es, den Test wirklich zu simulieren. Im Vergleich zu bestimmten deterministischen Methoden bedeutet die Verwendung von Positivkontrollen, dass die Nachweisgrenze der realen Probe bei jedem Testvorgang erneut überprüft werden kann.
Beachten Sie, dass die Nachweisgrenzen je nach Art des Behälters variieren. Je größer das Gefäß ist (z. B. mehrere Liter), desto höher ist die Nachweisgrenze. Die Nachweisgrenze hängt von der Fähigkeit der Flüssigkeit ab, den Behälter zu durchdringen.
Bei einem flexiblen 20-Liter-Flüssigkeitsbeutel beispielsweise liegt die Nachweisgrenze im Allgemeinen über 100μm, während die Nachweisgrenze bei einer Spritze oder einem Kanister von wenigen Millilitern bei ausreichend starken Druckschwankungen auf 30μm gesenkt werden kann.
Zur Herstellung der Positivkontrollen können Mikroröhrchen oder Mikrokapillaren verwendet werden, um die Mikrolöcher in den Proben zu simulieren.
Die Herstellung von Positivkontrollen ist eine heikle Aufgabe. Bei der Vorbereitung und dann beim Einsetzen der Kapillaren in die Proben ist es wichtig, dass die Kapillaren nicht verstopfen oder brechen.
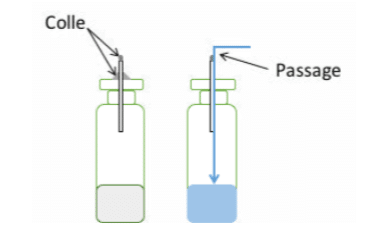
Ein weiterer wichtiger Punkt ist die Fixierung der Kapillaren. Wenn eine Kapillare nicht oder nicht richtig an der Probe abgedichtet ist, fließt die Flüssigkeit an ihr vorbei und nicht in sie hinein (siehe Abbildung 1), selbst wenn die Kapillare in einen Gummistopfen eingesetzt ist.
Der Gummistopfen schrumpft nicht perfekt um die Kapillare und lässt einen Durchgang für die Flüssigkeit frei. Es ist zu beachten, dass ein Zusammenhang zwischen der Länge der Kapillare und der Wahrscheinlichkeit des Durchflusses besteht, weshalb vor der Durchführung von Routinetests eine Validierung erforderlich ist.
Vorteile und Nachteile dieser Methode
Diese Methode hat eine Reihe von bekannten Nachteilen:
- Dabei handelt es sich um eine „destruktive“ Methode, bei der die Proben nicht wiederverwendet werden dürfen,
- In unmittelbarem Zusammenhang mit dem vorigen Punkt steht die Bewirtschaftung der anfallenden Abfälle, wobei auf mit Methylenblau verschmutzte Produkte geachtet werden muss.
- Die Nachweisgrenzen sind relativ hoch, können aber durch große Druckschwankungen verbessert werden,
- Die Analysezeit ist lang: Meistens braucht das Blau mindestens 30 Minuten, um einzudringen.
Trotz dieser Nachteile ist diese Methode in vielen Fällen immer noch vorteilhaft:
- Es funktioniert gleichermaßen gut bei kleinen und großen Mengen und auch bei Verpackungen unterschiedlicher Form und mit verschiedenen Verschließmethoden.
- Es ist relativ einfach einzurichten und erfordert keine teure Ausrüstung.
[1] PDA, Development of a Dye Ingress Method to Assess Container-Closure Integrity: Correlation to Microbial Ingress
[2] USP: The U.S. Pharmacopeial Convention





